Lo ione Ca2+ è un importante messaggero intracellulare che trasmette segnali di attivazione a numerose componenti intracitoplasmatiche. Il calcio svolge una funzione fondamentale in tutte le cellule e modula la contrazione delle cellule muscolari e la trasmissione dello stimolo chimico a livello sinaptico nei neuroni. Quando i potenziali di azione raggiungono la terminazione, il profilo spazio-temporale del calcio interno viene determinato dalla cinetica e dalla distribuzione dei canali calcio che interagiscono con il calcio endogeno e con i sistemi di pompe distribuiti all’interno della terminazione. L’onda di calcio libero risultante agisce sugli attivatori del rilascio sinaptico, collocati strategicamente nelle vicinanze del sito di rilascio. Questa azione determina la sequenza temporale e la probabilità del rilascio del neurotrasmettitore. Seguendo una rapida variazione di concentrazione, l’aumento di calcio viene rimosso dal citosol attraverso un processo che coinvolge la sua riassunzione da parte dei depositi a livello del reticolo endoplasmatico, il sequestro da parte dei mitocondri e/o l’estrusione nel mezzo extracellulare.
Al fine di fornire una più ampia panoramica dell’azione del calcio nei neuroni e delle proteine coinvolte nella sua cascata di segnalazione, verrà introdotta brevemente la trasmissione sinaptica e i compartimenti cellulari in essa coinvolti.
.jpg)
Figura 1. Un diagramma del terminale presinaptico e dei suoi meccanismi cellulari che contribuiscono alle dinamiche del calcio libero. Le deviazioni cellulari sono indicate da fumetti verdi, i processi di dinamica sono mostrati nei fumetti gialli, le frecce bianche indicano la direzione dell’azione. Da Dmitri A. Rusakov, Ca2+-Dependent Mechanisms of Presynaptic Control at Central Synapses, Neuroscientist 2006; 12; 317.
La trasmissione sinaptica inizia quando un potenziale d’azione induce il rilascio del neurotrasmettitore dal terminale nervoso. Un potenziale d’azione induce, tra l’altro, l’apertura dei canali Ca2+ e il conseguente aumento del calcio intracitoplasmatico stimola l’esocitosi delle vescicole sinaptiche. Dopo l’esocitosi, le vescicole sinaptiche subiscono un’endocitosi di recupero e vengono riempite nuovamente di neurotrasmettitore per iniziare un nuovo ciclo di esocitosi. La maggior parte dei neuroni formano più di 500 terminali nervosi presinaptici che sono spesso molto lontani dal soma neuronale, nel quale si origina il potenziale d’azione che viaggia attraverso tutto l’assone per essere trasformato in un segnale sinaptico secreto. Gli assoni non convertono ogni potenziale d’azione in un segnale secreto, dal momento che solo il 10-20% dei potenziali d’azione inducono il rilascio. La correlazione tra i potenziali d’azione e il rilascio nelle terminazioni nervose è regolata da messaggeri intracellulari e modulatori extracellulari ed è drasticamente alterata dall’uso ripetuto della sinapsi.
Tutte le funzioni presinaptiche, direttamente o indirettamente, coinvolgono le vescicole sinaptiche. Le vescicole sinaptiche subiscono un ciclo di movimentazione nell’assone, che può essere diviso in momenti successivi:
1. i neurotrasmettitori sono trasportati attivamente nelle vescicole sinaptiche (fase 1)
2. e le vescicole sinaptiche si raggruppano di fronte alla zona attiva (fase 2).
3. Le vescicole sinaptiche si ancorano alla zona attiva (fase 3),
4. dove le vescicole sono attivate (fase 4)
5. per essere convertite in uno stato di competenza per la successiva fusione indotta dal calcio (fase 5).
Dopo la fusione e l’apertura, le vescicole sinaptiche vengono endocitate e riciclate, probabilmente seguendo tre vie alternative:
(a) le vescicole vengono riacidificate e riempite nuovamente con il neurotrasmettitore senza disancorarle, quindi rimangono nel deposito di rilascio immediato (fase 6 chiamata “kiss-and-stay);
(b) le vescicole si staccano e vengono riciclate localmente (fase 7, chiamata “kiss-and-run) per essere riacidificate e riempite con il neurotrasmettitore (fasi 1 e 2);
(c) le vescicole vengono endocitate attraverso fossette rivestite di clatrina (fase 8) e riacidificate e riempite di neurotrasmettitore sia direttamente che dopo il passaggio per un intermedio endosomiale (fase 9).
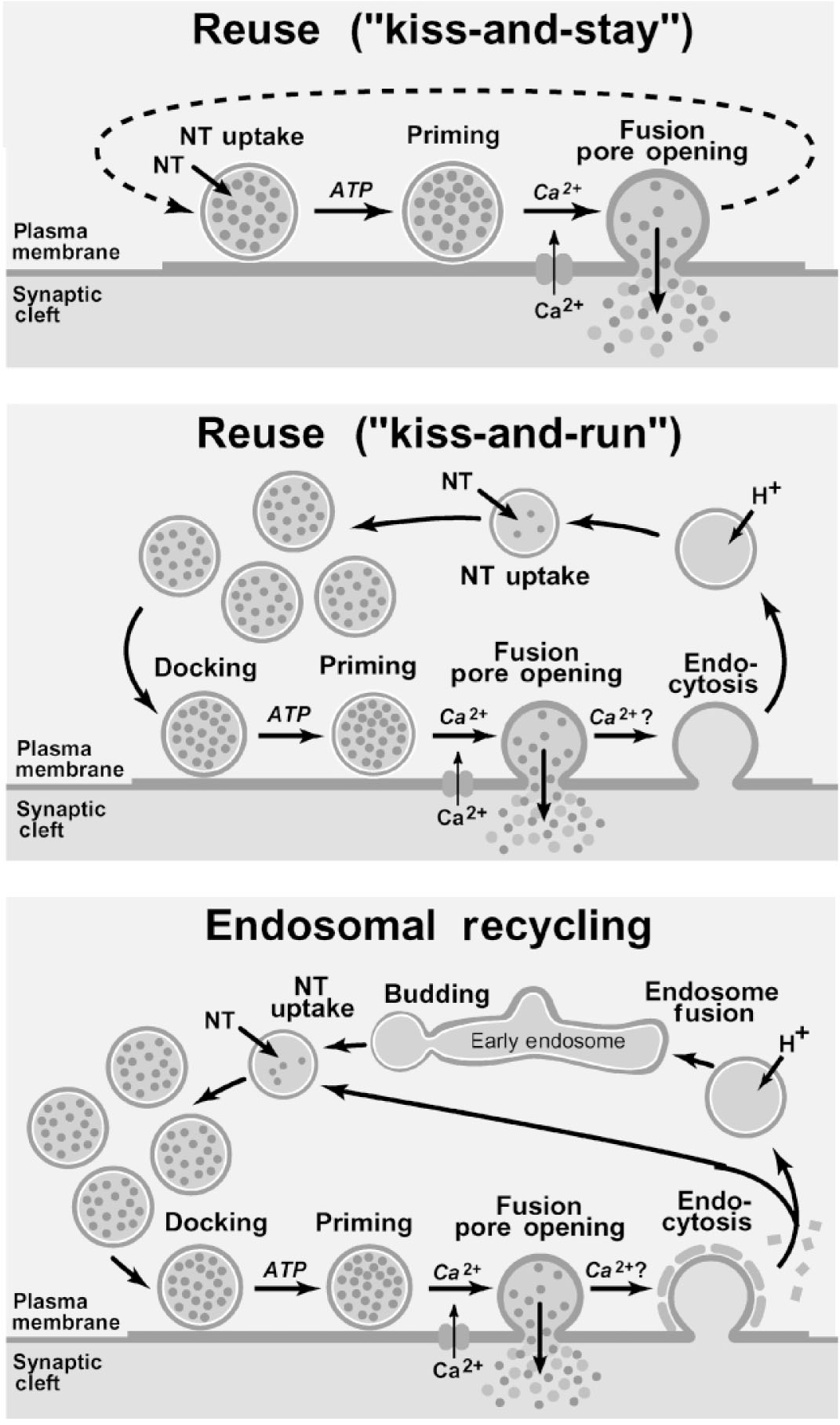
Figura 2. Da Thomas C. S¨udhof , THE SYNAPTIC VESICLE CYCLE. Annu. Rev. Neurosci. 2004. 27:509–47
La maggior parte delle fasi precedenti avvengono senza un gran movimento delle vescicole ad eccezione dell’ancoraggio (fase 3) e del riciclo (fasi 7-9). Le vescicole sinaptiche sono così piccole (diametro 17-22 nm) che anche una fusione instabile è probabilmente in grado di svuotare rapidamente la vescicola, come si può dedurre dal limitato tempo necessario per il rilascio spontaneo (inferiore ai 100 microsecondi).
In preparazione al rilascio di neurotrasmettitore, le vescicole sinaptiche si ancorano alla zona attiva e vengono attivate per diventare calcio-responsive. Quando un potenziale d’azione invade il terminale assonico, i canali Ca2+ voltaggio-dipendenti inducono l’apertura dei pori di fusione e il rilascio delle vescicole pronte. Nella maggior parte delle sinapsi, il rilascio è stimolato dall’ingresso di calcio attraverso canali di tipo P/Q-(CaV2.1) o N (CaV2.2), mentre i cancali di tipo R-(CaV2.3) o i più distanti L della serie CaV1 sono coinvolti solo raramente. Anche a riposo, le sinapsi hanno una certa probabilità, seppur bassa, di rilascio, dovuto a eventi spontanei di esocitosi, che sono riflessi nelle registrazioni elettrofisiologiche come minime correnti postsinaptiche.
L’ingresso di calcio attiva almeno due componenti del rilascio che sono probabilmente fisicamente distinte: una componente fasica sincrona e veloce indotta rapidamente, in meno di 50 microsecondi dopo che si sia stabilito il flusso di calcio e una componente più lenta, asincrona, che continua per più di 1 secondo sotto forma di aumento del tasso di rilascio spontaneo dopo il potenziale d’azione. Entrambi le componenti del rilascio sono strettamente calcio-dipendenti ma variano in maniera diversa dopo stimolazioni ripetute.
L’ingresso di calcio provoca un flusso di calcio che permane per 400-500 microsecondi, il cui sviluppo temporale segue quello della corrente di calcio, dal momento che il calcio viene inattivato in maniera efficiente e rapida. Gli ioni calcio quindi invadono il terminale assonico sotto forma di un breve impulso di calcio che attiva il rilascio rapido con un ritardo breve (50-500 microsecondi, in dipendenza della sinapsi e dalla temperatura). La rapida dissipazione del calcio, termina velocemente il rilascio, mentre il neurotrasmettitore rilasciato nella fessura sinaptica attiva i recettori postsinapici per evocare la risposta postsinaptica.
Da questo quadro si deduce che debbano esistere una o più proteine in grado di percepire la presenza di ioni calcio a livello citoplasmatico nella sinapsi e attivare quindi le fasi di rilascio. Queste proteine vengono genericamente indicate come ‘sensori del calcio’ e non sono state ancora definite con sufficiente certezza. Sulla base di esperimenti sia elettrofisiologici che genetici, sono stati proposti diversi modelli di azione delle vescicole sinaptiche e in particolare due di essi, entrambi con la presenza di un sensore del calcio a 5 siti di legame, hanno conquistato un buon credito presso la comunità scientifica. Il modello proposto da Bollmann et al. (2000) prevede che un potenziale d’azione induca un gradiente di calcio approssimativamente gaussiano, con una durata media di 400 μs. In questo modello, un potenziale d’azione causa una probabilità di rilascio delle vescicole immediatamente disponibili del 25% durante un potenziale d’azione con una disponibilità di circa 800 vescicole. Il modello di Schneggenburger & Neher (2000) predice un’ampio rilascio transiente di calcio (durata media di 500 microsecondi) con un picco di ampiezza di 28 μM di calcio che induce una probabilità di rilascio del 10% per le vescicole immediatamente disponibili (deposito di 2000 vescicole). Il rilascio è ristretto ad un breve periodo durante il quale in livello di calcio è al di sopra della soglia. Questi studi descrivono qualitativamente la proprietà di legame al calcio del sensore del calcio solo per il rilascio rapido ma danno poche informazioni riguardo al sensore del calcio per il rilascio asincrono o per l’adatttamento della macchina di rilascio durante una stimolazione ripetuta.
Esistono due punti di controllo del rilascio: il picco di concentrazione di calcio prodotto da un potenziale d’azione, cioè la conversione di un potenziale di azione in corrente di calcio, e la probabilità di rilascio per una data concentrazione di calcio, cioè la conversione del segnale del calcio in esocitosi. Entrambi i tipi di regolazione sono importanti. Il picco di concentrazione del calcio, dipende da diversi fattori che possono essere regolati: principalmente dalla forma del potenziale d’azione, dalla probabilità di apertura dei canali calcio e dalla concentrazione del calcio presente al momento in cui i canali calcio vengono aperti.
Il movimento del calcio all’interno della sinapsi:
a) i canali del calcio.
Il calcio attraversa la membrana presinaptica principalmente attraverso i canali calcio voltaggio dipendenti (VGCC). In accordo con le loro propietà di attivazione e con i profili farmacologici, i VGCC vengono divisi nei tipi P/Q, N, L, R (attivi ad alto voltaggio) e T (attivi a basso voltaggio). I singoli neuroni spesso esprimono tutti i tipi di VGCC, che sono comunque distribuiti in maniera differente nei vari compartimenti cellulari. In numerosi studi sperimentali effettuati sulle sinapsi centrali, l’ingresso presinaptico di calcio è stato associato principalmente con i VGCC di tipo P/Q e/o N, anche se è stato riportato il coinvolgimento di altri tipi di canale, in particolare i VGCC di tipo R. L’attivazione dei VGCC è guidata dal potenziale di membrana ma dipende anche molto dallo stato momentaneo del canale.
La corrente del calcio mantenuta dai diversi sottotipi di VGCC inattiva i canali stessi in maniera altamente specifica, dal momento che la sotituzione del calcio con il bario riduce drammaticamente questa inattivazione. L’inattivazione dei canali è pressocchè assente nel caso di impulsi rapidi, dal momento che le molecole tampone presenti nel citosol della sinapsi sono in grado di sottrarre gli ioni calcio in maniera rapida ed efficace.
Entrambi i canali N e P/Q contengono un sito di interazione specifica con le proteine sinaptiche (synprint) nell’ansa intracellulare che lega i domini II e III; questo sito lega proteine sinaptiche quali sintaxina-1, SNAP25 (proteina associata a i sinaptosomi di 25 kdalton), CSP (proteina a catene di cisteina), Rim e sinaptotagmina 1. Oltre a essere un bersaglio sinaptico chiave, la regione synprint sembra essere un importante sito di modulazione che permette alle proteine sinaptiche di regolare l’attività dei canali. I canali di tipo P/Q e N subiscono un’inibizione differenziale in risposta all’attivazione dei recettori accoppiati alle proteine G (GPCR). L’inibizione mediata da GPCR può presentare due componenti, una componente voltaggio dipendente (VD) che coinvolge il legame diretto della subunità βγ della proteina G alle regioni citoplasmatiche del canale e che è sensibile alla depolarizzazione di membrana; la seconda è una componente indipendente dal voltaggio (VI) che non è influenzata dal potenziale di membrana. La modulazione VD discrimina tra i canali di tipo P/Q ed N, dal momento che i canali di tipo N generalmente subiscono una forte inibizione e richiedono differenti determinanti nella struttura della subunità β della proteina G. Sebbene sia i canali di tipo N che quelli di tipo P/Q siano regolati dall’attività dei secondi messaggeri e associati con il meccanismo di rilascio delle vescicole sinaptiche, differiscono nella loro regolazione fine e nella loro capacità di integrare segnali multipli.
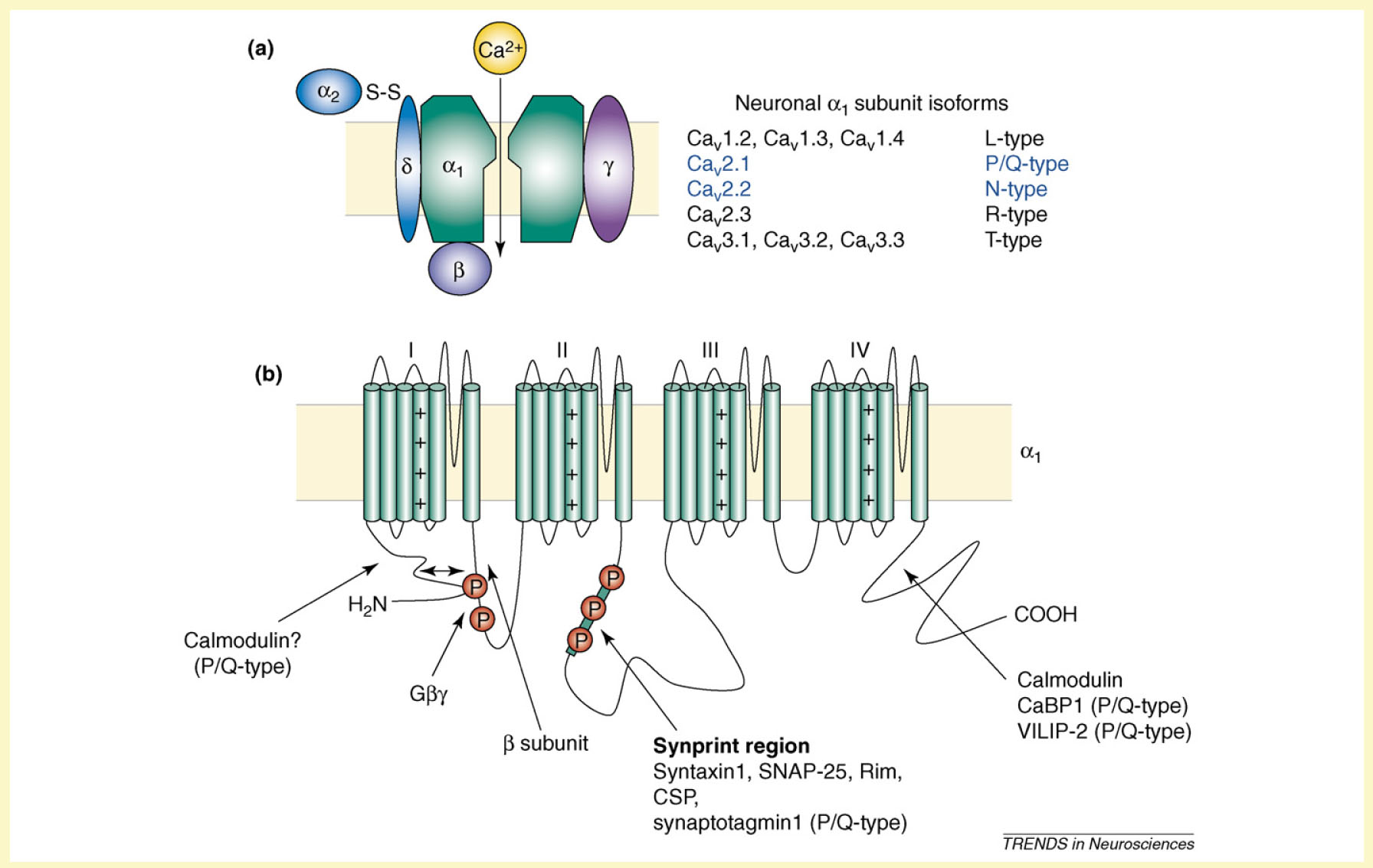
Figura 3. Aspetti strutturali dei canali Ca2+ voltaggio dipendenti. (a) subunità che compongono i canali Ca2+ e (b) topologia della porzione trnsmembrana della subunità a1. Sono indicati i siti chiave di interazione delle proteine. I cerchi rossi rappresentano i siti chiave di fosforilazione e i simboli + indicano le eliche transmembrana sensibili al voltaggio per ciascun dominio. Le subunità βγ della proteina G possono interagire a livello di una regione formata dall’N-terminale dei domini I e II dell’ansa intracitoplasmatica. da Rhian M. Evans and Gerald W. Zamponi, Presynaptic Ca2+ channels – integration centers for neuronal signalling pathways. TRENDS in Neurosciences Vol.29 No.11:617-624.
I canali per il calcio, in particolare quelli di tipo L, presentano una caratteristica inattivazione calcio dipendente (CDI), cioè un’accelerazione della loro cinetica di in attivazione in presenza di calcio. Questo processo coinvolge un’interazione fisica del C terminale del canale con la calmodulina che si è preassociata con il canale in assenza di calcio. A seguito dell’ingresso di calcio, i due siti di legame ad alta affinità per il calcio della calmodulina vengono occupati e si pensa che la calmodulina traslochi, grazie a un meccanismo molecolare sconosciuto, in una posizione differente sul C-terminale e acceleri la cinetica di in attivazione del canale. Nonostante tutti i tipi di canali calcio presentino questi siti di legame, esiste una differenza chiave tra i canali calcio di tipo L e gli altri: la CDI dei canali non-L dipende dalla bassa affinità dei siti per il calcio della calmodulina. Quindi, a differenza di quanto accade per i canali di tipo L, nei l’ingresso di calcio attraverso ciascuna singola molecola del canale è sufficiente per attivare la CDI, per i canali non-L è richiesto un aumento globale di calcio molto maggiore per indurre la CDI. Quindi, la CDI funziona come un meccanismo di retro regolazione dipendente dall’attività che riduce l’ingresso presinaptico del calcio. I canali calcio di tipo P/Q sono unici tra i canali non di tipo L nel fatto che essi mostrano anche una seconda forma di regolazione dipendente da calcio-calmodulina, chiamata facilitazione calcio dipendente (CDF). La CDF riflette un amento nell’attività dei canali P/Q a seguito di una precedente apertura del canale. La CDF sembra avvenire solo per i canali di tipo P/Q (cioè non per i canali di tipo N) e si basa sui siti di legame per il calcio ad alta attività della calmodulina come risulta evidente dalla sua insensibilità al tamponamento lento del calcio da parte dell’EGTA. Conseguentemente, l’ingresso di calcio attraverso un singolo canale di tipo P/Q è sufficiente per produrre la CDF. Quindi, la calmodulazione è un interruttore molecolare per passare dalla regolazione inibitoria (CDI) a quella stimolatoria (CDF) dell’attività del canale di tipo P/Q. Funzionalmente, le diverse affinità di legame della calmodulina, che si correlano con la CDF e la CDI potrebbero tradursi in una regolazione iniziale positiva dei canali di tipo P/Q, seguita da una regolazione negativa limitante quando i livelli globali di calcio aumentano. Oltre alla calmodulina, alcune altre proteine di legame al calcio regolano l’attività dei canali P/Q, attraverso l’interazione con il dominio C-terminale di legame al calcio (CBD). La CaBP1 (proteina che lega il calcio 1) media una variazione depolarizzante calcio-indipendente nell’attivazione voltaggio-dipendente del canale, inibendo quindi l’attività del canale. Anche la VILIP-2 (proteina simile alla visina) regola l’attività dei canali P/Q attraverso il legame con il dominio CBD ma, al contrario della calmodulina, rallenta la cinetica di inattivazione del canale. Sia la CaBP1 che la VILIP2 possono essere miristilate e quando questa miristilazione viene bloccata attraverso una mutagenesi sito-specifica, le azioni regolative tipiche di queste proteine vengono abolite e si comportano come la calmodulina nella loro regolazione dell’attività del canale.
b) i depositi di calcio intracellulare
Il calcio che raggiunge l’area citoslica della sinapsi può derivare, oltre che dal comparto extracellulare, anche da depositi intracelluolari, tra i quali il reticolo endoplasmatico. Il rilascio rapido del calcio dal reticolo endoplasmatico avviene attraverso due tipi di canali del calcio: i canali attivati dal calcio, comunemente conosciuti come recettori a rianodina, e i canali regolati dall’inositolo-3-fosfato, o recettori insP3.
c) Tamponamento rapido del calcio
Gran parte degli ioni calcio che entrano nel terminale sinaptico vengono rapidamente sequestrati da sistemi tampone, costituiti da proteine con particolare affinità per questo ione.
Un’ampia percentuale degli ioni calcio che entrano nel terminale presinaptico cono rapidamente legati dai tamponi calcio endogeni. Nella maggior parte dei casi, i tamponi calcio endogeni sono rappresentati da proteine che legano il calcio appartenenti alla famiglia delle proteine EF-hand: queste molecole sono caratterizzate da due o più motivi elica-ansa-elca ben conservati forniti di siti di legame ad alta affinità per gli ioni calcio. Tra le proteine che legano il calcio, sono comunemente espresse nei terminalil nervosi la calretinina (CR), la calbindina D-28k (CB) e la parvalbumina (PV). Queste proteine possiedono proprietà biofisiche lievemente differenti che determinano se la loro azione tampone sul calcio sia relativamente veloce (CR e CB) o lenta (PV) e se la loro solubilità/mobilità citosolica risulti elevata (PV e CR) o bassa (CB). Queste distinzioni sembrano determinare la specificità funzionale del tamponamento del calcio fornendo un controllo differenziale sulle dinamiche del calcio presinaptico in diversi tipi di sinapsi. Nel cervelletto, per esempio, CR è in gran parte espressa dalle cellule dei granuli e dagli assoni delle loro fibre parallele, mentre PV e CB sono presenti in assone, soma e dendriti e spine delle cellule del Purkinje. La modalità di tamponamento del calcio sembrerebbe essere specifica del tipo di connessione sinaptica.
d) Rimozione del calcio
Oltre ad essere tamponato dalle molecole citate in precedenza, il calcio può essere sottratto dal citosol tramite una rimozione ad opera di alcuni organelli, tra cui i mitocondri, che sembrano costituirne la componente principale. La via principale attraverso cui il calcio viene sequestrato, sembra coinvolga l’uniporto mitocondriale del calcio, localizzato sulla membrana mitocondriale interna. In tempi più brevi, l’ecesso di calcio viene rimosso dal citoplasma presinaptico principalmente grazie all’azione di due famiglie di pompe per il calcio, La calcio ATPasi della membrana plasmatici (PMCA) e la calcio ATPasi intracellulare del reticolo endoplasmatico (SERCA) e ache da uno scambiatore sodio/calcio ad affinità relativamente bassa.
Componenti del rilascio del neurotrasmettitore
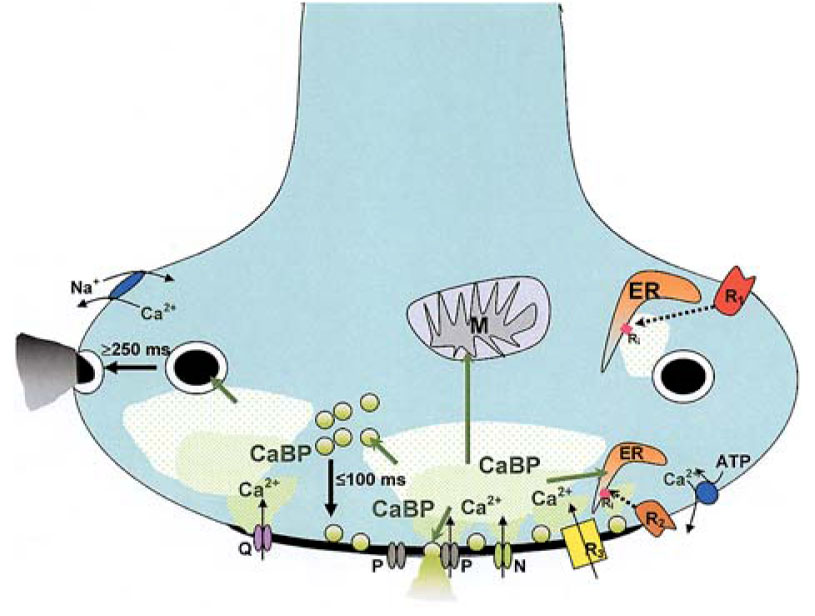
Figura 5. Modello di diferenziazione nella segnalazione presinaptica del calcio legata al rilascio del neurotrasmetore. Sono rappresentati i differenti elementi coinvolti nella esocitosi delle vescicole sinaptiche e la loro organizzazione spaziale intersinaptica. I canali calcio di tipo Q, P e N attivano localmente il rilascio del neurotrasmettitore dalle vescicole sinaptiche nella zona attiva a concentrazioni di calcio superiori a 5 mM. Le vescicole che hanno subito esocitosi vengono rimpiazzate da quelle derivanti dal pool di deposito e questo processo avviene entro 100 ms. La concentrazione di ione calcio vicino all’ingresso del canale attivato viene tamponata da proteine che legano il calcio con elevata affinità (CaBP). In caso di stimolazioni molto forti, le CaBP vengono presumibilmente saturate dagli ioni calcio, permettendo al calcio residuo di indurre la traslocazione delle vescicole di deposito da siti distanti verso la membrana plasmatica e la loro esocitosi. Gli ioni calcio possono essere mobilizzati dal reticolo endoplasmarico grazie ai recettori a rianodina o a inositolo-trifosfato (Ri), ai recettori posti a una certa distanza (R1) o a quelli posti vicino alla zona attiva (R2), inducendo quindi una esocitosi locale delle vescicole. In alternativa, l’attivazione diretta dell’esocitosi può avvenire attraverso l’ingresso di ioni calcio attraverso i recettori accoppiati a canali ionici (R3). Oltre al contributo delle CaBP, l’allontanamento rapido del calcio dal citosol può avvenire tramite il suo accumulo nelle vescicole sinaptiche, nel reticolo endoplasmatico e nei mitocondri (M) (modalità indicate dalle freccie verdi). Infine, il calcio ciene secreto dal terminale nervoso attraverso una calcio ATPasi in vicinanza della zona attiva e/o dal trasportatore di scambio Na+/Ca2+ in siti più distanti. Da Wim E. J. M. Ghijsen and A. G. Miriam Leenders. Differential signaling in presynaptic neurotransmitter release. Cell. Mol. Life Sci. 62 (2005) 937–954
a)Le proteine associate a vescicole.
Le vescicole sinaptiche sono piccole (∼20-nm di diametro) e la loro sola funzione conosciuta è quella di caricare e rilasciare il neurotrasmettitore. Sono relativamente semplici dal momento che un numero relativamente piccolo di molecole si possono associare in uno spazio così ridotto. Le vescicole purificate hanno un rapporto proteine:fosfolipidi di 1:3 con una peculiare composizione lipidica (40% fosfatidilcolina, 32% fosfatidiletanolammina, 12% fisfatidilserina, 5% fosfatidilinositolo, 10% colesterolo). La maggior parte delle proteine che sono state associate alle vescicole sinaptiche sono probabilmente presenti solo in un gruppo di vescicole o legate in maniera transiente ad esse. Quindi il numero di proteine che sono parte costitutiva di tutte le vescicole sinaptiche potrebbe essere abbastanza piccola. Le vescicole sinaptiche contengono due classi di componenti obbligati: le proteine di trasporto coinvolte nel trasporto all’interno di esse del neurotrasmettitore e le proteine del traffico che partecipano all’eso- ed endocitosi e al riciclo delle vescicole sinaptiche. Le proteine di trasporto sono composte di una pompa protonica di tipo vacuolare che genera un gradiente elettrochimico, che fornisce energia per l’assunzione e il trasporto del neurotrasmettitore. Il proteoma del traffico delle vescicle sinaptiche è complesso e include proteine intrinseche di membrana, proteine associate attraverso modificazioni lipidiche post-traduzionali e proteine legate perifericamente. Queste proteine non mostrano caratteristiche che le possano rendere identificabili come proteine di vescicole sinaptiche e si conosce poco circa il modo in cui queste proteine siano associate in maniera specifica nelle vescicole sinaptiche. Molte delle proteine sinaptiche conosciute, anche se non tutte, interagiscono con proteine non vescicolari e sono legate a funzioni specifiche.
b)La fusione delle vescicole e le proteine SNARE.
La fusione delle membrane vescicolare e sinaptica coinvolge le proteine SNARE che sono presenti su entrambe le membrane prima della fusione e che si associano in stretti complessi durante questo processo. Le proteine SNARE sono caratterizzate da una sequenza omologa di 70 residui chiamata motivo SNARE. Il complesso centrale si forma quando quattro motivi SNARE (presenti in tre o quattro proteine SNARE separate, dal momento che alcune contengono due motivi SNARE) si assemblano in un gruppo di quattro eliche parallele, con le regioni transmembrana delle SNARE che emergono al C-terminale. La formazione del complesso centrale potrebbe forzare le membrane sulle quali le SNARE risiedono in stretta vicinanza, iniziando quindi la fusione della membrana.
Esistono quattro differenti classi di motivi SNARE (motivi R, a, Qb e Qc) e i complessi SNARE stabili si formano solo quando la tetraelica contiene un motivo SNARE per ciascuna classe. L’interazione tra le SNARE è abbastanza promiscua in vitro, sebbene in vivo formino complessi altamente specifici. La specificità è probabilmente dovuta, almeno in parte, alle sequenze delle proteine SNARE che si trovano al di fuori dei loro motivi SNARE. L’esocitosi delle vescicole è mediata da tre proteine SNARE: la sinaptobrevina (chiamata anche proteina di membrana associata alle vescicole) sulle vescicole sinaptiche, la sintaxina1 e la SNAP25 sulla membrana plasmatica presinaptica. Il centro del complesso sinaptico è formato dal motivo R-SNARE della sinaptobrevina, dal Qa-SNARE della sintaxina e dai motivi Qb e Qc-SNARE della SNAP25 (che contiene due motivi SNARE). Un modello proposto, prevede che il complesso SNARE, trattenendo vicine la vescicola sinaptica e la membrana plasmatica, crei un intermedio instabile senza aprire il poro di fusione. Questo intermedio instabile può evolvere in un poro di fusione completamente aperto o regredire allo stato di vescicola ancorata che non contiene SNARE impegnate. La complessina, una piccola proteina neuronale, si lega ai complessi centrali sinaptici assemblati e si inserisce in una tasca nella metà C-terminale del complesso SNARE, elemento che è assentre nei complessi SNARE incompleti. La complessina non è essenziale per la funzione delle SNARE o per la fiusione delle vescicole ma promuove l’azione della sintagmina1. La formazione del complesso SNARE nella sinapsi e in altre reazioni di fusione intracellulare, è probabilmente controllata da una classe di proteine di fusione essenziali, chiamate proteine SM (proteine simili a Sec1/Munc18) che spesso interagiscono con le SNARE della famiglia della sintaxina. Munc18-1, una proteina SM che controlla la fusione sinaptica, di lega alla sintaxina in conformazione chiusa e blocca il suo motivo SNARE impedendole di partecipare alla formazione del complesso SNARE. Comunque la regolazione della formazione del complesso SNARE attraverso un meccanismo sterico, non è la funzione caratteristica delle proteine SM, dal momento che molte proteine SM si legano alle proteine della famiglia della sintaxina in conformazione aperta. Sebbene le proteine SM siano generalmente richieste per la fusione di membrana e solitamente interagiscano con le SNARE della famiglia della sintaxina, le interazioni stesse variano a seconda della reazione di fusione presa in considerazione. Molte proteine sinaptiche possono regolare l’assemblamente dei complessi SNARE. Due proteine solubili, chiamate tomosina e amisina, possiedono un motivo R-SNARE al C-teminale che può sostituirsi al motivo della sinaptobrevina nella formazione del complesso. La tomosina e la amisina non mostrano alcuna altra somiglianza- la tomosina è una proteina abbastanza grande, con più di 1100 residui, che appartiene alla famiglia delle cosiddette lethal-giant-larvae proteins, mentre l’amisina è una proteina piccola di 222 residui- ma entrambe le proteine, quando introdotte in modo esogeno nel sistema secretorio, inibiscono l’esocitosi, interferendo con l’azione della sinaptobrevina. Un’altra classe di proteine che può regolare la funzione SNARE nella sinapsi, è quella delle sinaptofisine, proteine abbondanti nelle vescicole sinaptiche che si legano direttamente alla sinaprobrevina. La sinaptobrevina non può legarsi simultaneamente alla sinaptobrevina e partecipare anche al complesso SNARE. Questo suggerisce che il legame della sinaptobrevina con la sinaptofisina riduca la disponibilità di sinaptobrevina per la fusione.
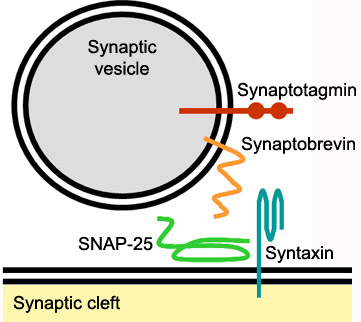
Figura 6. Diagramma della possibile interazione tra le proteine presenti sulla vescicola sinaptica e quelle presenti nella zona attiva. Da www.neuro.wustl.edu
Oltre agli eteromultimeri, sia la sinaptofisina che la sinaptobrevina si associano in omooligomeri, attraverso le loro regioni transmembrana. Sono stati osservati dimeri solo della sinaptobrevina, mentre la sinaptofisina si associa in esameri o in ampi oligomeri. Le proteine delle vescicole sinaptiche sinaptobrevina e sinaptofisina quindi, sono impegnate in almeno tre complessi sulla superficie delle vescicole sinaptiche: omooligomeri separati e etrooligomeri comuni. C’è abbastanza accordo sul fatto che le proteine SNARE abbiano un ruolo nella fusione, ma non si conosce la precisa natura della loro attività. Dal momento che la maggior parte delle proteine SNARE contengono altre sequenze essenziali e quindi conservate, a fianco al motivo SNARE, è importante differenziare tra le funzioni SNARE mediate dai loro motivi SNARE (ad esempio la formazione dei complessi centrali) e le funzioni SNARE mediate da altre sequenze (ad esempio l’interazione con le proteine della famiglia Sec1/Munc18). Sono state avanzate due ipotesi principali per spiegare la funzione SNARE: a) le SNARE sono minuscole macchine per la fusione che da sole guidano la fusione attraverso i loro motivi SNARE e tutte le altre interazioni sono secondarie; b) le SNARE sono solo componenti della macchina di fusione, che comprende altre proteine. Almeno a livello della sinapsi, il complesso SNARE è essenziale solo per una fusione efficiente e fisiologicamente regolata ma non per la fusione in se stessa.
Oltre a costringere le membrane ad avvicinarsi, probabilmente le proteine SNARE hanno funzioni addizionali importanti, per esempio nell’assicurare la specificità spaziale e temporale delle reazioni di fusione attraverso l’inclusione dell’avvicinamento delle membrane in una sequenza di reazioni ordinata. Questa inclusione è probabilmente guidata dalle sequeze delle SNARE al di fuori del motivo SNARE e potrebbe richiedere, anche le proteine SM, insieme ad altre.
Il ruolo del calcio nel rilascio del neurotrasmetitore
l’esocitosi rapida è indotta dal legame del calcio a un sensore che presenta almeno 5 siti di legame per il calcio con affinità micromolare. Prove accumulate negli scorsi 13 anni dimostratno che questi sensori sono due proteine associate alle vescicole sinaptiche, chiamate sinaptotagmina 1 e 2.
Le sinaptotagmine sono composte di una corta sequenza intravescicolare all’N-terminale, di una singola regione trasnsmembrana, di una corta sequenza liker e di due domini C2 citoplasmatici (i domini C2A e C2B). Le sinaptotagmine 1 e 2 sono proteine abbondanti nella vescicola sinaptica e sono espresse differenzialmente. La maggior parte degli esperimenti sono stati effettuati sulla sinaptotagmina 1 ma i limitati studi sulla sinaptotagmina2, il suo elevato livello di omologia di sequenza con la sinaptotagmina1 e la distribuzione reciproca della sinaptotagmina 1 e 2, suggeriscono che queste due proteine siano funzionalmente simili. Oltre alla loro distribuzione differenziale, la principale differenza tra la sinaptotagmina 1 e 2 è una variazione di almeno 2 volte nell’affinità apparente per il calcio. Il dominio C2A della sinaptotagmina1 lega tre ioni calcio e il dominio C2B ne lega due. Le affinità intrinseche per il calcio dei domini C2 sono molto basse (0.5–5 mM) dal momento che gli orbitali di coordinazione per gli ioni calcio sono incompleti. L’affinità apparente per il calcio di questi domini aumenta drasticamente (fino a 1000 volte) quando i domini C2 si legano alle membrane fosfolipidiche le cui teste caricate negativamente forniscono siti di coordinazione addizionali per il legame agli ioni calcio. Due esperimenti hanno dimostrato che la sinaptotagmina1 è essenziale per la sensibilità al calcio per l’esocitosi rapida ma non per la componente lenta dell’esocitosi o per la fusione di membrana in generale. Nel primo, la perdita di sinpatotagmina nei topi produce un fenotipo letale che è associabile a una perdita selettiva dell’esocitosi veloce guidata da calcio. Nessun altro parametro del traffico di membrana era influenzato. Nel secondo, una mutazione puntiforme nel dominio C2A della sinaptotagmina1 che altera l’affinità totale apparente per il calcio della sinaptotagmina stessa, induce una variazione identica nell’esocitosi dell’affinità apparente per il calcio.
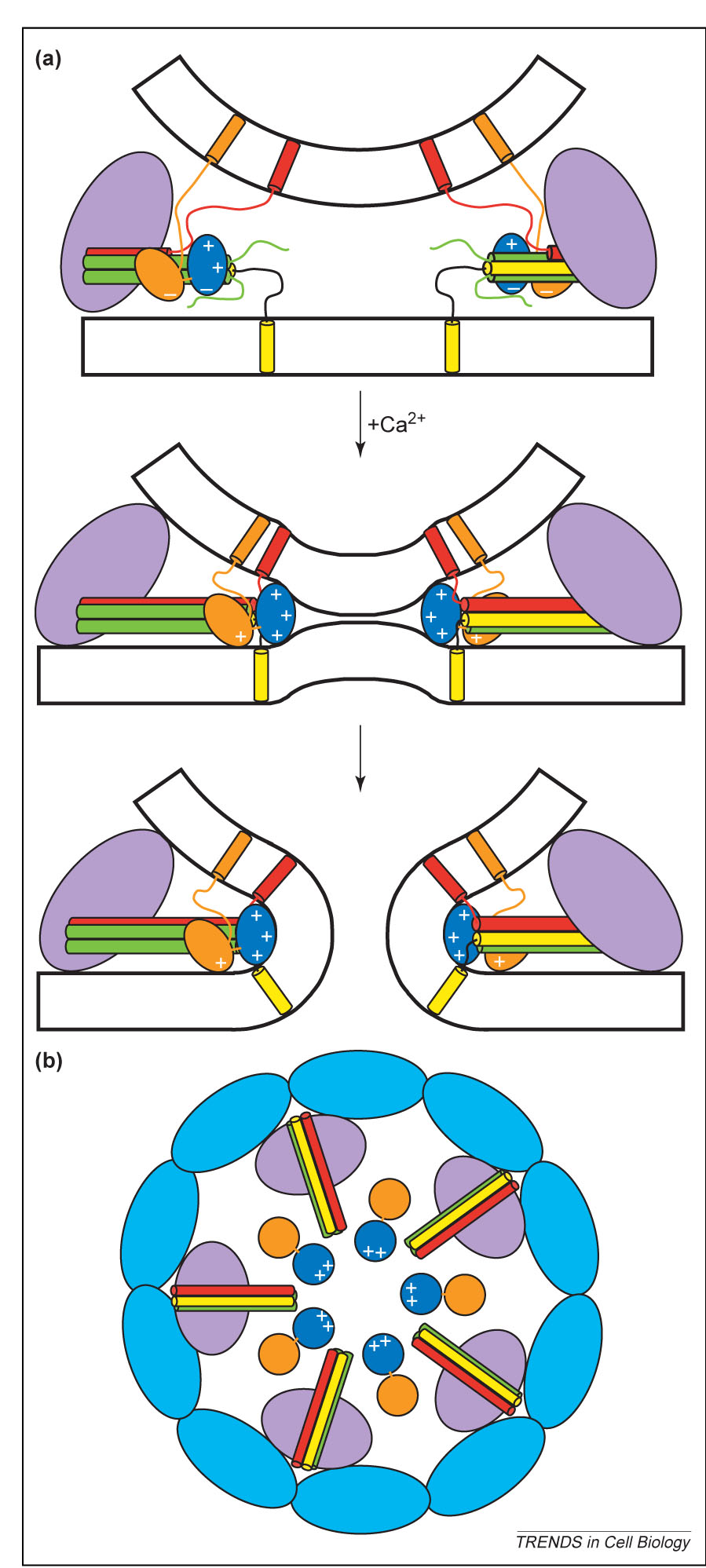
Figura 4. Modello della regolazione del rilascio da parte del calcio attraverso la cooperazione tra la sinaptotagmina, le SNARE e le altre proteine. Nel modello i domini C2 della sinaptotagmina sonon rappresentati con ellissi arancio (C2A)ve blu (C2B) (a) o cerchi (b) a seconda delle diverse visioni e i segni – e + rappresentano le carattersistiche generali dei potenziali elettrostatici dei domini C2 che potrebbero essere importanti per l’impedimento o l’attivaizone del rilascio prima e dopo l’ingresso di calcio, rispettivamente. Il modello predice che la sinaptotagmina si trovi parzialmente legata ai complessi SNARE assemblati prima dell’ingresso del clacio (a) dal momento che l’assemblamento completo forzerebe la i domini c2B della sinaptotagmina a entrare in contatto con entrambe le membrane, cosa che sarebbe sfavorita a causa dela repulsione tra le regioni di legame al calcio caricate positivamente e una membrana; tale repulsione potrebbe contribuire al successivo progredire verso la fusione. Si presume che i complessi SNARE siano, almeno parzialmente, assemblati prima che l’ingresso di calcio provochi la massima velocità del rilascio. Il modello predice anche che l’ingresso del calcio porti al legame del dominio C2B a entrambe le membrane e il completo asssemblamento dei complessi SNARE (a). Il potenziale elettrostatico altamente positivo dei domini C2B multipli organizzati in un anello, accelera la fusione di membrana, avvicinando le due membrane caricate negativamente. da Josep Rizo, Xiaocheng Chen and Demet Arac. Unraveling the mechanisms of synaptotagmin and SNARE function in neurotransmitter release. TRENDS in Cell Biology Vol.16 No.7:339-350.
a) Meccanismo di azione della sinaptotagmina1
Oltre a formare complessi calcio-dipendenti con i fosfolipidi (che sono essenziali per aumentare l’affinità apparente per il calcio), le sinaptotagmine 1 e 2 si legano anche ai complessi SNARE. Il legame ai complessi SNARE è in parte indipendente dal calcio. Inoltre la sinaptotagmina 1 e 2 formano omomultimeri sia calcio-indipendenti (attraverso le loro regioni transmembrana N-terminali) sia calcio-dipendenti (attraverso il loro dominio C2B). L’interazione calcio-dipedente della sinaptotagmina1 con il complesso SNARE non è essenziale per la regolazione del rilascio da parte del calcio, dal momento che lo ione stronzio può sostituire il calcio nell’attivazione del rilascio ma non è in grado di stimolare il legame al complesso SNARE. Questa scoperta ha stabilito che l’attivazione dell’esocitosi veloce indotta dal legame del calcio alla sinaptotagmina 1 non avviene attraverso un legame calcio-indotto della sinaptotagmiana alle SNARE ma ciò non significa che il legame con SNARE non sia importante. In realtà, il legame indipendente al calcio della sinaptotagmina 1 potrebbe servire per posizionare la sinaptotagmina 1 vicino ai complessi SNARE dopo che questi si siano assemblati ma prima che il foro di fusione sia stato aperto. Anche il legame calcio-dipendente della sinaptotagmina 1 ai complessi SNARE potrebbe essere funzionalmente importante, per esempio nel reclutare le vescicole nel deposito di utilizzo immediato. Un possibile modello derivato da queste osservazioni si basa sul concetto che la formazione del complesso SNARE costringa le vescicole sinaptiche in uno stato intermedio di fusione instabile che verrebbe stabilizzato dal legame della complessina ai complessi SNARE. La sinaptotagmina 1 lega il compleso SNARE in assenza di calcio ma passa alla membrana fosfolipidica non appena il calcio entra attraverso i canali specifici. Il legame dei domini C2 della sinaptotagmina 1 ai fosfolipidi, con l’inserzione parziale di amminoacidi idrofobici derivati dalla sinaptotagmiana 1 e lo stresso meccanico indotto dal legame, potrebbero quindi destabilizzare l’intermedio di fusione e aprire il poro di fusione. Questo modello ha il vantaggio di spiegare alcune caratteristiche chiave del rilascio. Inanzitutto è veloce: dal momento che tutto il calcio impegnato nel legame con la sinaptotagmina 1 provoca un cambiamento nel legame con le altre proteine, causando uno stress meccanico, la reazione di legame del calcio alla sinaptotagmina 1 è rapida. In secondo luogo, è cooperativa: la sinaptotagmina lega cinque ioni calcio e quindi ha il numero di siti di legame al calcio richiesti. Terzo spiega il fenotipo nullo per la sinaptobrevina: l’attivazione del rilascio calcio-dipendente è repressa in modo molto più pesante nei topi nulli per la sinaptobrevina piuttosto che il rilascio calcio-indipendente, indicando come un complesso SNARE correttamente assemblato può non essere assolutamente essenziale per la fusione, ma piuttosto per la regolazione legata al calcio. Quarto giustifica il fenotipo nullo per la complessina: i topi nulli per la complessina mostrano un fenotipo che ha caratteristiche meno gravi del fenotipo nullo per la sinaptotagmina 1 e questo è in accordo con il concetto che la complessina stabilizzzi i complessi SNARE, fatto essenziale per il corretto posizionamento della sinaptotagmina 1.
A dispetto di queste prove a favore, tuttavia, il modello è lontano dall’essere provato e sono possibili interpretazioni alternative. Per esempio, non sono stati riportati mutanti della sinaptotagmina 1 che siano ancora in grado di legare il calcio ma non di interagire con i complessi SNARE e non è stata studiata la possibilità o meno che la sinaptotagmina 1 possa legare il complesso SNARE simultaneamente alla complessina. Quindi, sebbene sembri certo che il legame del calcio alla sinaptotagmina 1 (e alla sinaptotagmina 2) attivi il rilascio rapido, il meccanismo di attivazione è probabilmente intimamente connesso alle proteine SNARE.
b) I sensori per il calcio per l’esocitosi asincrona o ritardata.
Le due sinaptotagmine sembrano essere coinvolte solo nell’attivazione del rilascio rapido. La sinaptotagmina appartiene a una famiglia genica che contiene 15 membri nei vertebrati. Tra questi solo le sinaptotagmine 1-7 e 9-11 posiedono sequenze coerenti con il legame del calcio ad almeno uno dei due domini C2. Tuttavia, misurazioni dirette hanno rilevato che non tutti i domini C2 delle sinaptotagmine che presentavano probabili siti di legame, in realtà legano davvero il calcio. Per esempio, i domini C2B della sinaptotagmina 3 e della sinaptotagmina 9, sebbene includano tutti siti dedotti di legame per il calcio, sono inattivi. E’ quindi probabile che altre sinaptotagmine funzionino come sensori del calcio per la componente lenta dell’esocitosi. Conferme per questa ipotesi derivano dall’osservazione che le ‘altre’ sinaptotagmine 3, 6 e 7 esibiscono un’affinità per il calcio superiore. Il rilascio asincrono, sebbene intrinsecamente più lento rispetto dalla componente veloce, è probabilmente indotto da concentrazioni di calcio inferiori. Il gradiente di calcio indotto da un potenziale di azione ha una emivita veramente breve (∼400 μs), sufficiente per attivare il rilascio veloce, ma il calcio residuo decade più lentamente e attiva ancora il rilascio asincrono a concentrazioni di calcio inferiori.
c)Le SV2 possono regolare I livelli di calcio
La SV2 costituiscono una componente delle vescicole sinaptiche e dei granuli secretori neuroendocrini in tutti i vertebrati ma non sono conservate negli invertebrati. Tre geni SV2 nei vertebrati codificano proteine altamente omologhe identificate con i nomi SV2A, SV2B, SV2C. Le proteine SV2 contengono 12 probabili regioni transmembrana con C-terminale ed N-terminale e mostrano un’omologia significativa con le proteine di trasporto dei carboidrati sia negli eucarioti che nei batteri. La maggior parte delle anse che connettono le regioni transmembrna, sono corte, ad eccezione di un’ampia ansa intravescicolare che è altamente glicosilata e potrebbe formire una matrice ionica alla regione interna della vescicola sinaptica. La comparazione tra le isoforme SV2 mostra che le regioni transmembrana e le anse citoplasmatiche sono altamente conservate, mentre la sequenza N-terminale citoplasmatica e le anse intravescicolari mostrano un’omologia molto bassa. Le tre proteine SV2 sono espresse in maniera differente nell’encefalo. SV2A è presente in quasi tutti i neuroni, SV2B mostra una distribuzione più ristretta e SV2C è presente solo in un piccolo gruppo di neuroni nell’encefalo anteriore ventrale e nelle regioni caudali dell’encefalo. Oltre alle proteine SV2, le vescicole sinaptiche contengono una proteina correlata ma più distante, chiamata SVOP. SVOP possiede una struttura transmembrana simile a SV2 ma manca dell’ampia ansa intravescicolare glicosilata. Inoltre, SVOP è altamente conservata negli invertebrati, mentre SV2 non lo è. Queste differenze suggeriscono che le proteine SV2 potrebbero essere comparse evolutivamente tardi e potrebbero essere discendenti di SVOP specifici dei vertebrati. Inizialmente, gli scienziati pensarono che SV2A potesse essere un trasportatore di neurotrasmettitore ma la sua presenza nei terminali nervosi con neurotrasmettitori diversi fece crollare quest’ipotesi. Studi elettrofisiologici su colture cellulari che presentavano mutazioni nelle SV2 hanno registrato la mancanza in questi neuroni di un aumento nella trasmissione sinaptica calcio-dipendente quando vengono attivati due o più potenziali d’azione in successione. Questa osservazione suggerisce che la delezione di SV2 causi un accumulo presinaptico di calcio durante potenziali di azione consecutivi. SV2 potrebbe quindi essere un trasportatore del calcio nelle vescicole sinaptiche. Tuttavia lo studio dei fenotipi dei mutanti nulli per questa proteina mal si correla con questa funzione. La struttura di SV2 è quella di un trasportatore, con poche sequenze esposte nel citoplasma, quindi è plausibile che SV2 sia un trasportatore, ma il trasporto di calcio deve essere ancora dimostrato direttamente e altri cationi potrebbero potenzialmente essere substrati per la sua attività di trasporto.
d) le sinapsine
Un altro gruppo di proteine correlate allo ione calcio nelle sinapsi sono le sinapsine, proteine abbondanti delle vescicole sinaptiche che rivestono la superificie delle vescicole stesse come proteine periferiche di membrana. Le sinapsine furono scoperte come substrati neuronali per le chinasi attivate da Amp ciclico e calcio/calmodulina e nonostante siano state le prime proteine di vescicola identificate, la loro precisa funzione resta da chiarire.
I tre geni per le sinapsine presenti nei mammiferi esprimono varianti derivate da spicing alternativo che possiedono domini centrale e N-terminale simili ma che possiedono diverse sequenze al C-terminale. La maggior parte delle sinapsi esprimono le sinapsine 1 e 2, mentre le varianti della sinapsina 3 sono meno abbondanti.
Tutte le sinapsine contengono:
a) un corto dominio N-terminale (circa 20 residui) con un sito di fosforilazione conservato per la PKA e per la protein chinasi I calcio/calmodulina dipendente,
b) una sequenza linker e
c) un ampio dominio C centrale (circa 300 residui) che costituisce più della metà delle sequenze della maggior parte delle sinapsine.
A livello del C-terminale, le sinapsine sono composte da sequenze variabili, derivate da splicing alternativo. Il dominio C delle sinapsine forma un dimero costitutivo e lega l’ATP con elevata affinità. La struttura cristallina del dominio C della sinapsina 1 rivela una forte somiglianza con una famiglia di ATPasi. Questa famiglia include la glutatione sintetasi e la D-alanina:D-alanina ligasi, fatto che suggerisce che le sinapsine possano essere enzimi che utilizzano l’ATP. I domini di legame all’ATP delle diverse sinapsine mostrano proprietà differenti:
• la sinapsina 1 lega ATP solo in presenza di calcio,
• la sinapsina 2 lega ATP a prescindere dalla presenza del calcio
• la sinapsina 3 lega ATP solo se il calcio è assente.
Gli esperimenti su organismi transgenici hanno dimostrato che i domini N-terminali delle sinapsina 1 sono sufficienti per indirizzarle sulle vescicole sinaptiche. Le sinapsine si legano avidamente alla superficie dei lipidi attraverso il loro corto dominio N-terminale, che quando viene fosforilato dalla PKA e dalla protein chinasi I calcio/calmodulina dipendente abolisce il legame delle sinapsine alle vescicole sinaptiche. Come risultato, le sinapsine attivano il ciclo di attacco e distacco delle vescicole in modo dipendente dalla stimolazione. Tuttavia non è chiaro se le sinapsine esplichino questa azione normalmente durante l’esocitosi e l’endocitosi o solo sotto estensiva stimolazione.
Figura 7. Immunofluorescenza su neuroni ippocampali che mostra la distribuzione delle sinpasine a livello dendritico (in blu). La fluorescenza verde di fondo è data dalla transfezione di eGFP. Da www.sysy.com/synapsin/synapsin_if.html
L’analisi dei topi nulli ha dimostrato che le sinapsine 1 e 2 non sono essenziali per la sopravvivenza del topo o per l’esocitosi delle vescicole sinaptiche ma sono richieste per mantenere il normale numero di vescicole sinaptiche e per regolare la plasticità sinaptica a breve termine. La delezione delle sinapsine diminuisce il numero delle vescicole senza alterare l’aggregazione delle vescicole o il loro ancoraggio. Il fenotipo nullo per la sinapsina 2 è più grave di quello per la sinpasina1 e il fenotipo doppio nullo mostra i cambiamenti maggiori, incluso una diminuzione del 50% nel numero delle vescicole. La perdita delle vescicole sinapriche nei topi mutanti per le sinapsine indica per queste proteine una funzione di mantenimento, probabilmente attraverso un’attività ATP-dipedente. La delezione delle sinapsine causa anche drammatici cambiamenti nella plasticità sinaptica a breve termine. La plasticità sinaptica a breve termine coinvolge cambiamenti nel rilascio quando due o più potenziali di azione sono attivati in pochi millisecondi. Il breve intervallo di tempo nella plasticità sinaptica a breve periodo, suggerisce che questo tipo di plasticità regoli l’interazione delle vescicole sinaptiche con la zona attiva. Attraverso la loro interferenza, le sinapsine possono quindi regolare questa interazione, ma il meccanismo di tale regolazione e la sua relazione con la funzione di mantenimento delle sinapsine non è chiaro. Sono stati analizzati anche i topi nulli per la sinapsina 3, ma solo isolati, senza incroci con i topi nulli per la sinapsina 1 e la sinapsina 2. Questi topi esibiscono discreti cambiamenti, per esempio un aumento del 5% nella densità delle vescicole sinaptiche e un cambiamento nella risposta sinaptica evocata dal GABA. L’osservazione di effetti diversi dovuti alla delezione delle varie sinapsine è corroborata dalla differente regolazione del legame del’ATP alle sinapsine attraverso l’intermediazione del calcio, che sia sitimola il legame all’ATP (sinapsina 1), sia è ininfluente (sinapsina 2), sia inibisce il legame con l’ATP (sinapsina 3). Probabilmente le sinapsine si legano a numerosi elementi nel citoscheletro, specialmente con l’actina, portando all’ipotesi che le sinapsine possano ancorare le vescicole sinaptiche presenti nei gruppi presinaptici al citoscheletro. Tuttavia, tenendo conto che i gruppi di vesciole mature virtualmente non contengono citoscheletro, questa ipotesi non riesce a spiegare le funzioni delle sinapsine. Al momento c’è un vuoto tra la definizione strutturale delle sinapsine come molecole che legano l’ATP e il loro ruolo funzionale nel mantenere l’integrità delle vescicole e nel regolarne il rilascio. La domanda fondamentale è se il legame dell’ATP alle sinapsine sia funzionalmente importante, se la fosforilazione delle sinapsine giochi un ruolo fisiologico, a che punto del ciclo sinaptico le sinapsine siano attive.
Approfondimenti
Introduzione alle sinapsi chimiche
Una serie di monografie sulla struttura delle sinapsi
Le vescicole sinaptiche e i complessi SNARE